De DNA-dialoog
door Gerard Feller
De DNA-dialoog bestaat uit een serie gesprekken en debatten die tussen medio 2019 en eind 2020 door het hele land plaatsvinden. Het doel is erachter te komen wat de Nederlandse samenleving vindt van het bewerken van het embryo-DNA. De uitkomsten van de dialogen worden gebundeld en aangeboden aan politici, wetenschappers en de Nederlandse samenleving (1).
De 20ste eeuw was de ‘gouden eeuw’ van de ontwikkeling van computers, de 21ste eeuw is de ‘gouden eeuw’ van de genetica. Wereldwijd is er veel discussie over de vraag of we het DNA van embryo’s mogen aanpassen. Als je dat DNA aanpast, verander je namelijk ook het DNA van volgende generaties. Het aanpassen van DNA zo vroeg in het leven, wordt kiembaanmodificatie genoemd.
Waar gaat de DNA-dialoog over? (2)
1. Het aanpassen van DNA in embryo’s.
2. Het selecteren van embryo’s om te voorkomen dat het kind een erfelijke ziekte met zich meedraagt.
3. Het kweken van menselijke organen in dieren.
4. Het maken van ‘kunstmatige embryo’s.
Definitie (3)
Genetische technologie of gentechnologie is een moderne vorm van biotechnologie waarbij het DNA van een organisme direct wordt aangepast. Dit in tegenstelling tot de klassieke biotechnologie waarbij het DNA van een organisme indirect wordt aangepast, bijvoorbeeld door te kruisen (4). Genetische manipulatie is het inbrengen van een stukje DNA van het ene organisme in het andere. Deze techniek noemt men een recombinant DNA-techniek.
Dit is veel ingrijpender en verstrekkender dan genetische modificatie op lichaamscellen.
Het basisprincipe van alle technieken verloopt via een vast aantal stappen.
1. Isolatie van het gen dat je wilt aanpassen (DNA uit de cellen halen).
2. Het eventueel aanpassen van het geïsoleerde gen.
3. Het overbrengen van het gen in een geschikte vector (bijvoorbeeld een virus, stukje bacterieel DNA, liposoom* of een goudkogeltje beplakt met DNA).
4. Transformatie van de cel of het organisme dat je wilt aanpassen. Bijvoorbeeld het ‘inschieten’ van het DNA of via bacteriën.
5. Selectie van de gemodificeerde cellen of organismen.
(* een liposoom is een kunstmatig gesynthetiseerd deeltje dat bestaat uit een door een membraan omgeven inhoud)
Het DNA moet in het zgn. genoom worden opgenomen. Het genoom is het totaal van de erfelijke informatie van een cel. De technieken van het overbrengen van genen zijn nog lang niet altijd succesvol. Wetenschappers moeten namelijk weten welke cellen het DNA nu daadwerkelijk opgenomen hebben. Ze maken daarvoor een zogenaamd ‘marker-gen’ vast aan het nieuwe gen, voordat dit wordt overgebracht. Zo’n marker-gen codeert bijvoorbeeld resistentie tegen een antibioticum of een bestrijdingsmiddel. Vervolgens worden de genetische cellen gekweekt in een voedingsbodem waarin het antibioticum of het bestrijdingsmiddel zit. Daarna overleven alleen de organismen die het nieuwe gen met bijgevoerde marker het nieuwe DNA hebben opgenomen. De cellen worden verder gekweekt en ontwikkelen zich verder. Het is vaak onmogelijk om het inbrengen van een nieuw gen goed te reguleren, en deze willekeur kan het sterk gereguleerde netwerk van DNA in een organisme verstoren.
CRISPR-Cas9 een methode voor kiembaanmodificatie
In november 2018 schrikte de wereld op toen de Chinese onderzoeker He Jiankui het nieuws naar buiten brengt dat hij het DNA van twee baby’s heeft veranderd. Met behulp van de techniek CRISPR-Cas9 veranderde hij het DNA in de embryo’s zodanig dat de kinderen later een kleinere kans zouden hebben om besmet te raken met het aidsvirus. Deze kiembaanmodificatie en is de kern van de DNA-dialoog. De wijzigingen in de kiembaancellen van een embryo zijn permanent en daardoor wordt het gewijzigde DNA doorgegeven aan het nageslacht. De Chinese onderzoeker liep hiermee ver vooruit op wat er wetenschappelijk, klinisch en ethisch als aanvaardbaar wordt gezien. Hij had dit experiment in het geheim gedaan, zonder overleg met een wetenschappelijke of ethische raad. De wetenschappelijke wereld viel over hem heen. Men vond dat hij te veel risico’s had genomen en onverantwoordelijk had gehandeld. Later erkende de Chinees dat het experiment mislukt was. Momenteel is het onduidelijk waar de meisjes, genaamd Lulu en Nana, zijn. De geboorte van Lulu en Nana laat zien waarom wetenschappers voorzichtig om moeten gaan met de CRISPR-Cas-techniek.
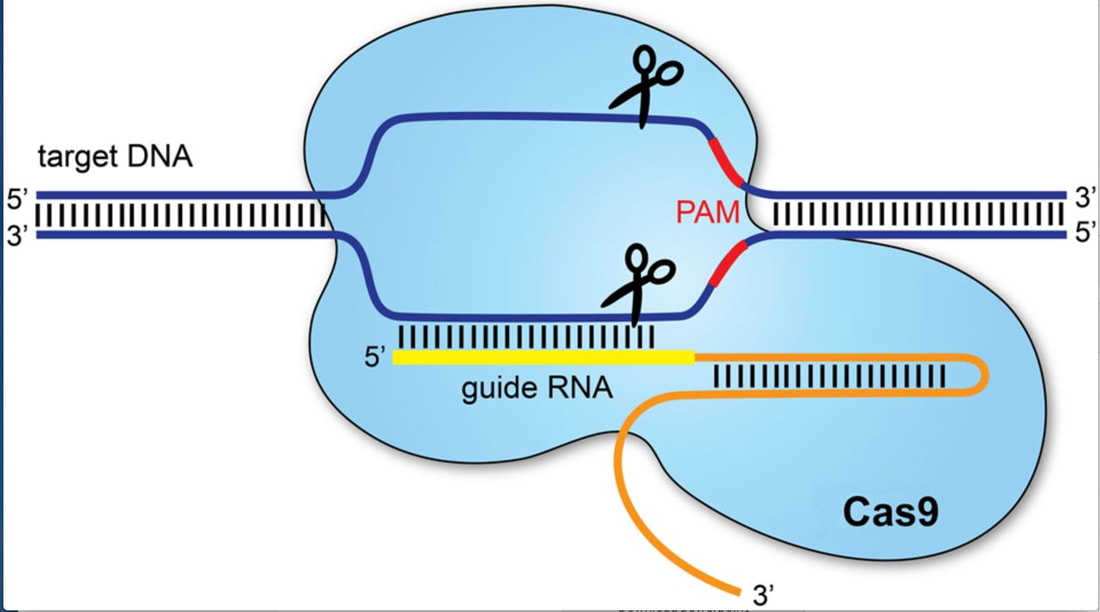
Onderstaande tekening geeft de recombinant - DNA-techniek schematisch weer
Om een fout stukje DNA (mutatie) aan te passen zijn drie dingen nodig:
1) Een gidsmolecuul (guide RNA) dat het foute stukje DNA herkent.
2) Cas die het DNA knipt (Inschieten of via bacteriën).
3) Een stukje DNA zonder fout.
Cas en het gidsmolecuul speuren samen het DNA af tot het gidsmolecuul het foute stukje DNA herkent. Dan knipt Cas dit foute stukje DNA weg. Op de plaats van het foute DNA komt het goede DNA zonder fout. Fout DNA kan dus worden gerepareerd. Deze techniek biedt mensen met een erfelijke ziekte mogelijkheden voor behandeling.
Met CRISPR-Cas kan ook het DNA van embryo’s worden aangepast. Zo kan worden voorkomen dat mensen erfelijke ziekten doorgeven aan hun kinderen
De toekomst van genetische manipulatie
In Nederland zou het experiment van He Jiankui niet mogen plaatsvinden omdat embryo’s niet ‘gecreëerd’ mogen worden voor wetenschappelijke doeleinden. Een kunstmatige bevruchting mag alleen gedaan worden met een zwangerschap als doeleinde, niet voor de wetenschap. Ook mogen Nederlandse wetenschappers het DNA van een embryo nog niet aanpassen, dus ziekten wegknippen in het DNA is in Nederland niet mogelijk. In de Verenigde Staten, het Verenigd Koninkrijk, Zweden en België mag dit wel. In Nederland wordt wel gesproken over een mogelijke verruiming van de Embryowet, onder andere in 2016 door oud-minister van Volksgezondheid Edith Schippers.
Zij stelde voor om de wet te verruimen voor embryo-onderzoek ten behoeve van vruchtbaarheidsproblemen, kanker en ernstige erfelijke ziekten. In maart 2017 gaf de Gezondheidsraad het advies aan de minister dit wel toe te staan. De raad beargumenteert dat het niet in strijd is met de menselijke waardigheid wanneer kweekembryo’s (onder strikte voorwaarden) worden gebruikt voor onderzoek dat gericht is op het voorkomen van ernstige aandoeningen. Volgens de NPV (de Nederlandse Patiëntenvereniging) is een embryo pril leven en is het intrinsiek waardevol. Embryo’s verdienen dus bescherming. De NPV vindt dat embryo’s er niet zijn om gebruikt te worden, maar om voldragen te worden in de veilige omgeving van een baarmoeder (5).
Mogelijkheden met Crispr-Cas
Met de komst van Crispr-Cas, de knip- en plaktechniek waarmee in het lichaam van een patiënt DNA nauwkeurig kan worden gerepareerd, lijkt gentherapie een nieuw tijdperk in te gaan. DNA repareren en corrigeren, genen afplakken en bijzetten: nu het complete genoom van de mens in kaart is gebracht, blijkt het mogelijk om in het boek van het leven de drukfouten uit te gummen, of tenminste te vervagen. Het herstel van die fouten kan de haperende fabriek in de cel weer op gang brengen. Zo kan een patiënt met een erfelijke aandoening in feite zijn eigen medicijn aanmaken.
“Wat we tot nu doen, is wat merkwaardig”, erkent stamcelbioloog Staal van het LUMC (Leids Universitair medisch centrum). “We plaatsen bij de klassieke gentherapie in de cel er een gezond gen bij, alsof je een kapotte koplamp in je auto hebt en de garagehouder zegt: we zetten wel een extra lamp op het dak, dan heb je ook licht”. Met Crispr-Cas kan de koplamp zelf worden gerepareerd, maar Staal is nog terughoudend. ”De mogelijkheden worden overschat. Om een gen te repareren moet je er wel bij kunnen, en het DNA zit in een celkern behoorlijk opgevouwen. En wat in een kweekschaaltje werkt of in een muis, hoeft bij een mens nog niet effectief te zijn. Bij een baby moet je alleen al 50 miljoen stamcellen repareren (6)”.
Na decennia van beloften zijn ook in Nederland nu de eerste genetische behandelingen op de markt gekomen, onder andere voor leukemie en voor de ernstige spierziekte SMA. Twee gentherapiemiddelen, voor patiënten met een erfelijke netvliesaandoening en de bloedziekte bèta-thalassemie, worden beoordeeld. Onlangs is bij het Europees Geneesmiddelenbureau (EMA) de eerste registratieaanvraag ingediend voor gentherapie tegen hemofilie A. Wereldwijd zijn honderden onderzoeken gaande naar de inzet van genetische therapieën, ruim negentig studies zijn in de eindfase, noteert de VIG, de koepel van farmaceutische bedrijven, in een recent rapport (6)
De aanvliegroutes bij al die behandelingen variëren, afhankelijk van de aandoening die wetenschappers willen aanpakken. Ze stoppen een gezond stukje DNA in onschadelijk gemaakte virusdeeltjes, die daarna zelf hun weg vinden, als een brief met bijzondere inhoud die op de juiste bestemming wordt afgeleverd. Of ze maken een soort masker dat in celkernen een stukje genetisch materiaal afplakt, waardoor dat niet meer werkt. Of ze halen immuun cellen uit het lichaam en bewerken die zodanig dat ze na terugplaatsing een tumor kunnen herkennen. Of, de laatste aanwinst in het veld, ze sturen synthetische knip- en plakmachientjes het lichaam in, die een DNA-fout kunnen corrigeren.
Genezing van de ziekte van Batten? (6)
De 8-jarige Mila Makovec haalde afgelopen najaar de internationale media omdat Amerikaanse artsen speciaal voor haar een genetisch medicijn hadden ontwikkeld. Mila heeft de dodelijke ziekte van Batten; door een DNA-fout stapelden zich in haar cellen afvalstoffen op waardoor ze snel achteruitging. Dankzij een op maat gemaakte genetische pleister, betaald met de 3 miljoen dollar die haar ouders hadden ingezameld, kon de fout worden gemaskeerd waardoor haar achteruitgang werd stopgezet. Het verhaal van Mila schiep wereldwijd verwachtingen, die ook de werkkamer van de Leidse hoogleraar translationele genetica Annemieke Aartsma-Rus bereikten.
Elke maand komen er nieuwe vragen binnen, vertelt ze, van patiënten, ouders en wetenschappers die maar één ding willen weten: wat bij Mila lukte, kan dat ook voor een andere genetische ziekte? Mila werd geholpen met een zogeheten antisense-oligonucleotide (ASO), een soort pleister die voorkomt dat de verkeerde code in haar DNA wordt overgedragen aan de fabriek in de cel. De ontwikkelingen rond die ASO's gaan snel, zegt Aartsma-Rus: wereldwijd zijn tien medicijnen op de markt, zes ervan dateren van de afgelopen paar jaar. De komende tijd wordt ook in Nederland onderzoek gedaan naar de inzet van een ASO bij de dodelijke ziekte van Huntington. “Maar nu de misvatting”, zegt Aartsma-Rus, “wat voor Mila kon, kan echt niet bij alle ziekten. Tim Yu, de Amerikaanse geneticus die het Mila-medicijn maakte, waarschuwde onlangs op een congres voor valse verwachtingen” (6).
Embryo’s kweken voor onderzoeksdoeleinden zijn nodig om de Crispr-Cas methode verder te ontwikkelen.
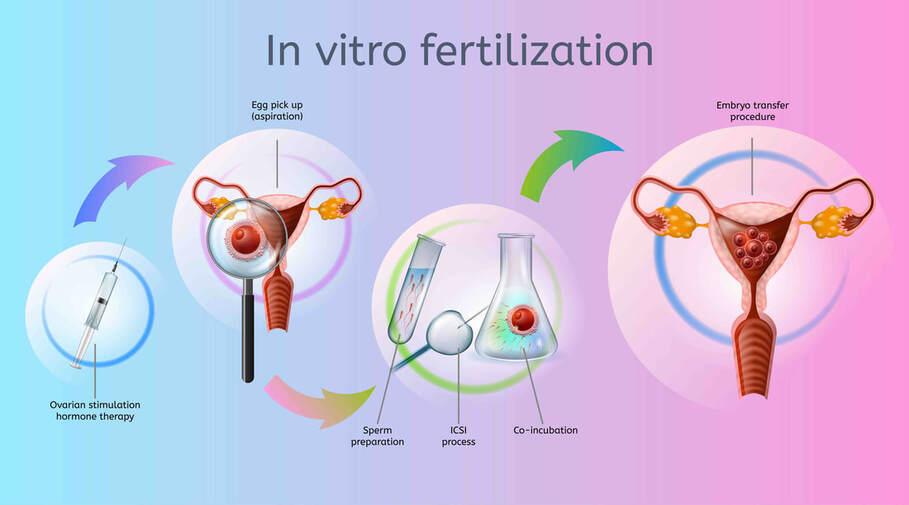
Met embryoselectie kun je de geboorte van een kind met een ernstige genetische aandoening voorkomen. Embryoselectie wordt uitgevoerd bij echtparen die een sterk verhoogd risico hebben op een kind met een genetische aandoening, zoals taaislijmziekte, de ziekte van Huntington of een ernstige spierziekte. Een ander woord voor deze methode is PGD, pre-implementatie diagnostiek. Door een ivf-behandeling worden embryo’s gecreëerd. Deze embryo’s worden vervolgens onderzocht op de aanwezigheid van de betreffende ziekte. Daarna wordt op de vierde of de vijfde dag na de bevruchting besloten welke embryo’s in aanmerking komen voor terugplaatsing in de baarmoeder. De embryo’s die overblijven worden vernietigd. De kans op zwangerschap na terugplaatsing is ongeveer 25 procent
In Nederland worden ouders en embryo’s beschermd door veel regels, vastgesteld op basis van wetenschappelijke ethiek. In 2002 is in Nederland de Embryowet ingevoerd. Hierin is vastgelegd wat wel en niet mag in embryo-onderzoek en Ivf-behandelingen (in-vitrofertilisatie, ook wel reageerbuisbevruchting). Ouders die kinderen via IVF willen krijgen, geven meerdere eicellen en zaadcellen aan het ziekenhuis, waarvan vervolgens embryo's gemaakt worden. De overgebleven embryo's mogen gebruikt worden voor onderzoek naar het verbeteren van IVF. Thans mogen alleen de ‘restembryo’s’ gebruikt worden die vier dagen oud zijn, maar eerder niet.
Na 14 dagen moeten deze zogenaamde restembryo’s vernietigd worden. Ook mag weefsel van geaborteerde kinderen na toestemming van de ouders gebruikt worden. Voorstanders van het kweken van embryo’s geven aan dat ook bij een ‘natuurlijke reproductie’ veel fouten voorkomen. Slechts één op de vijf natuurlijk ontstane embryo’s haalt het tot het einde van de zwangerschap, omdat het merendeel al vroeg na de bevruchting vanwege grote afwijkingen afsterft. Dat gebeurt vaak nog voordat de vrouw überhaupt weet dat ze zwanger is. Daarnaast heeft 5% van de baby’s die wel levend geboren worden een genetische afwijking (7).
Wanneer begint leven?
Opvallend genoeg hebben veel christenen geen moeite met IVF terwijl bij deze methode toch ‘restembryo’s’ zijn die gedood worden of voor genetisch onderzoek gebruikt worden. Gelukkig is er ook een meerderheid bij christenen die het ‘kweken’ van embryo’s voor onderzoeksdoeleinden in zijn algemeenheid afwijst. Een heel belangrijke fundamentele vraag in de hele DNA-dialoog is: Wanneer is er sprake van leven?
Steve Jacobs een bekend onderzoeker vroeg aan 5577 biologen wanneer het menselijk leven begint. Bijna allen (96 %) bevestigden dat nieuw menselijk leven begint na de bevruchting (8). Abortus werd in de USA gelegaliseerd na een cruciale rechtszaak (Roe vs. Wade 1973) omdat er toen geen consensus bestond over de vraag wanneer menselijk leven begint. Opvallend is dat men toen toch besloot abortus te legaliseren omdat je niet weet of je met abortus een menselijk leven doodt. Nu is de wetgeving in verschillende staten in de USA verschillend.
Sommige staten verbieden abortus, andere legaliseren juist abortus tijdens de gehele zwangerschap. Het eindproduct van een zoogdierlijke bevruchting is een bevruchte eicel (zygote), het is een nieuw zoogdierlijk organisme in het eerste stadium van de levenscyclus binnen het genoom van zijn soort.
In een eerder artikel in Promise zijn we uitgebreid ingegaan op de vraag wanneer leven begint In dit artikel beweert Francis J. Backwith: “In de loop van de geschiedenis zijn er in de abortusdiscussie veel criteria genoemd om te beoordelen wanneer een menselijk organisme in zijn ontwikkeling het punt bereikt heeft waarin het volledig mens genoemd kan worden. Sommige criteria zijn gebaseerd op zogenaamde ‘beslissende’ momenten in de ontwikkeling van de foetus. Andere criteria berusten op bepaalde voorwaarden waaraan een wezen, al of niet geboren, moet voldoen om als een menselijk wezen beschouwd te worden.
En weer anderen beweren dat er geen ‘beslissend’ moment is, maar dat, naarmate de ongeborene groeit, er steeds meer aanspraak op het mens-zijn mogelijk is. Ik ben van mening dat al deze standpunten gebrekkig zijn. In dit artikel verdedigt ik het pro-life standpunt, dat inhoudt dat volledig mens-zijn begint bij de conceptie. Dit is het meest coherent is en in overeenstemming met onze fundamentele waarden. Om dit standpunt adequaat te verdedigen, zal ik in dit artikel kritiek leveren op enkele criteria die worden gehanteerd tegen de pro-life visie”, aldus Backwith (10). Ook in dit Promise Magazine wordt in het artikel ‘Is pro-life hermeneutiek mogelijk?’ de beschermwaardigheid van het embryo verdedigd.
Veel Pro-Choice activisten geven ook toe dat “De Pro-Life groepen gelijk hebben met hun stelling dat de plaats waar de baby zich bevindt, binnen of buiten de baarmoeder, niet van cruciaal belang is”. Het is daarom niet logisch dat we het goed vinden als een baby één week voor de geboorte gedood wordt terwijl zodra het geboren wordt, alles gedaan moet worden om de baby in leven te houden.
Kunstmatige voortplanting
In het blad Leef van oktober 2019 (9) schrijft Shanti Bolt dat in het LUMC onderzoekers zijn bezig geweest om gedoneerde vrouwelijke embryo’s en foetussen te gebruiken voor onderzoek naar verdergaande artificiële voortplanting. De vrouwelijke embryo’s hebben namelijk zelf ook een voortplantingsorgaan. Hierin bevinden zich eicellen in wording voor de volgende generatie. Men onderzocht welke omgevingsfactoren nodig zijn voor de ontwikkeling van deze eicellen. Dit was de sleutel tot het maken van eicellen uit stamcellen. Zo is het uiteindelijk gelukt om van stamcellen uit de huid van volwassenen geslachtscellen (eicellen en zaadcellen) te maken!
Dit betekent volgens Bolt dat uiteindelijk zelfs geen baarmoeder meer nodig is omdat er gewerkt wordt aan ‘een kweekzak’ waar het kindje 9 maanden in een juiste omgeving kan groeien (9). Dat zou in de toekomst kunnen betekenen dat men geen ‘restembryo’s’ meer nodig heeft om leven ‘te maken’. Enerzijds zou dit in de toekomst betekenen dat er geen ‘restembryo’s’ gebruikt worden, anderzijds wordt kinderen krijgen steeds meer als een maakbaar ‘project’ van de ouders gezien. Naast het DNA is in het Bijbelse mensbeeld de relatie van ziel en geest van een mens beslissend voor zijn ontwikkeling en menszijn.
Dr. Henk Jochemsen, ex-directeur van het Lindeboom Instituut, geeft ook aan dat een embryo een mens in wording is en daarom volledige bescherming geniet. Hij juicht in principe toe dat erfelijke ziekten worden bestreden door kiembaanmodificatie, mits de techniek veilig is en er geen embryo’s nodig zijn voor onderzoek. Hij stelt in het Lindeblad tegelijk de vraag of de toepassing van de techniek daartoe beperkt zal blijven. “Er is geen harde grens te trekken tussen het genezen van ziekten en ‘mensverbetering’”. Krijgen we in de toekomst een ‘mens op bestelling’, waarbij we de gewenste eigenschappen in het DNA plakken?
Dat staat volgens Jochemsen haaks op het ontvangen van het leven als gave en het besef dat volkomenheid er pas zal zijn in Gods toekomst (11). Een designer baby op bestelling lijkt op komst. Wetenschappers maken steeds minder onderscheid tussen wat ze kunnen en moeten doen. David Hirsch zegt dat postmodernisten zich goed moeten realiseren dat het onmogelijk is een menselijk wezen te fragmenteren tot onderdelen zonder dat het individu in de werkelijke wereld waardeloos wordt (10). Het wettelijk onderscheid tussen leven en machine, tussen leven en product, begint te verdwijnen. We zijn getuige van een depersonalisatie van menselijk leven, indien alle delen van mensen en genetische materialen worden verkocht en gepatenteerd, bewerkt en ontwikkeld.
PGD
PGD is een afkorting voor pre-implantatie genetische diagnostiek. Dit is een methode waarmee de geboorte van kinderen met een ernstige genetische aandoening voorkomen kan worden. PGD wordt uitgevoerd bij paren die een sterk verhoogd risico hebben op het krijgen van een kind met een genetische aandoening, bijvoorbeeld een chromosoomafwijking, taaislijmziekte, hemofilie, de ziekte van Huntington of een ernstige spierziekte.
Voor PGD is een Ivf-behandeling noodzakelijk. Hierbij wordt – na bevruchting van eicellen met zaadcellen buiten het lichaam – één cel afgenomen van embryo’s. Deze cel wordt in het laboratorium onderzocht op de aan- of afwezigheid van de betreffende ziekte. Op basis hiervan wordt op de vierde of de vijfde dag na de bevruchting besloten welke embryo’s in aanmerking komen voor plaatsing in de baarmoeder. Alleen embryo’s zonder de genetische ziekte waarop het onderzoek was gericht, worden in de baarmoeder geplaatst. De kans op zwangerschap na terugplaatsing is ongeveer 25% (PGD Nederland; Handyside 2018) (12). Zoals eerder vermeld is het doden van restembryo’s voor veel christenen een brug te ver.
Next Generation Sequencing
In het Lindeblad van november 2014 (staat niet in lit. lijst, wel iets uit 2019) worden ook de gevaren van een toenemende genetische screening besproken. Verdere ontrafeling van het menselijke DNA-profiel is mogelijk geworden door de zgn. Next Generation Sequencing (N.G.S.) De mogelijkheden met betrekking tot het voorspellen van het krijgen van aandoeningen zijn enorm toegenomen ten opzichte van de ’oude DNA-screeningsmethode’. Er kunnen veel meer basenparen (erfelijk materiaal) tegelijk afgelezen worden dan vroeger. Bovendien kan door middel van N.G.S. veel sneller dan voorheen een diagnose en prognose vastgesteld worden. Door deze nieuwe manier van screening worden juridische en ethische bezwaren tegen gen-screening extra benadrukt.
Een praktijkvoorbeeld (7)
Diagnostiek om dragerschap van een ziekte te voorkomen. De vraag is of IVF-PGD mag worden toegestaan om aan de wens van de toekomstige ouders tegemoet te komen. Deze wens is: “Mijn partner en ik willen géén meisjes, want dat zullen dragers zijn van hemofilie (7). Wij willen voorkomen dat de ziekte wordt doorgegeven en onze kleinkinderen het dus weer zouden kunnen krijgen en we willen ook voorkomen dat onze kinderen (als zij meisjes zijn) voor dezelfde lastige vraag komen te staan als zij over kinderen krijgen nadenken”.
Om dit overigens begrijpelijke verzoek toe te staan, moet men voorlopig via de ivf-procedure toestaan dat restembryo’s gedood worden.
Zijn er alternatieven? (7)
Deze zijn: (a) afzien van het krijgen van genetisch ‘eigen’ kinderen, (b) gebruik maken van sperma of eicellen van donoren of te kiezen voor draagmoederschap, (c) gebruik van prenatale diagnostiek (NIPT) en eventueel afbreking van de zwangerschap, (d) spermaselectie, (e) kiembaan-modificatie, (f) naar het buitenland gaan waar de behandeling wel beschikbaar is, (g) of het aanvaarden van het risico op een kind met dragerschap. Bij al deze alternatieven zijn vraagtekens te plaatsen. Spermaselectie en kiembaanmodificatie hebben nog een lange weg te gaan en het is niet duidelijk of het überhaupt tot ethisch verantwoorde klinische toepassingen zal komen. De meeste genoemde opties lijken me voor christenen om de eerder in dit artikel genoemde bezwaren niet wenselijk.
Het aanvaarden van het risico op een kind met dragerschap zou een optie kunnen zijn voor christenen die er in gebed van uit kunnen gaan dat in het geval van een erfelijke aandoening God hen de kracht en visie geeft hun kinderen in moeilijke omstandigheden op te voeden. Alternatieven die misschien voor sommigen een optie zijn, is het afzien van het krijgen van genetisch eigen kinderen, en overgaan tot adoptie of gastouderschap om toch kinderen te kunnen opvoeden en verzorgen.
Organen kweken in dieren?
Feitelijk gaat het om twee typen mens-diercombinaties, namelijk cybriden en iPS-cellen.
De eerste – cybriden –spelen momenteel geen rol van betekenis (meer). Deze cybriden ontstaan doordat de kern van een menselijke cel wordt ingebracht in een ontkernde dierlijke eicel. Zo komt een embryo tot stand met 99,9 procent menselijk DNA in de celkern en 0,1 procent dierlijk DNA in de mitochondriën. Cybriden waren bedoeld als alternatief voor onderzoek met menselijke embryo’s, maar die belofte is niet uitgekomen.
In het tweede type draait het om iPS-cellen, ‘gewone’ cellen die zijn geherprogrammeerd tot stamcellen met embryonale eigenschappen. Wanneer menselijke iPS-cellen of ‘gewone’ embryonale stamcellen worden ingebracht in een dierlijk embryo heb je te maken met een ‘chimaera’. Het idee is dat langs deze weg op den duur menselijke, lichaamseigen organen in dieren te kweken zullen zijn. Fundamenteel onderzoek heeft inmiddels laten zien dat dit in principe mogelijk is (14)
Inmiddels is het gelukt met stamcellen van varkens een alvleesklier in andere varkens te kweken. Op dezelfde manier kunnen mogelijk stamcellen van mensen in een dier uitgroeien tot het gewenste orgaan. Dit orgaan zou zeer geschikt zijn voor transplantatie, vooral ook omdat er bij gebruik van stamcellen, organen ‘op maat’ (met cellen van de patiënt zelf) gemaakt zouden kunnen worden. Of eigenlijk: de wens is zelf mens-dieren tot stand te brengen, chimaeren (‘mengsels’), om zo menselijke nieren, levers, harten en andere organen te laten groeien. Dit soort onderzoek staat in Nederland ter discussie, en is onder de huidige Embryowet verboden. In 2017 heeft het Ministerie van VWS een rapport laten schrijven voor het publieke debat over verbieden of niet-verbieden van het kweken van menselijk organen in dieren en de ethische vragen daaromheen.
Christelijke visie op chimaeren (15)
Een principieel bezwaar hierbij is het ‘respect voor de menselijke waardigheid’. Stel dat chimaeravorming kan leiden tot een deels menselijk brein, of tot de vorming van menselijke geslachtscellen? Mocht onderzoek met mens-dier chimaeren al in de toekomst worden toegestaan, dan pleit de NPV ervoor dat als voorwaarde wordt gesteld dat daarbij geen menselijke embryo’s ‘verbruikt’ worden. In een christelijke visie is er een fundamenteel verschil tussen een mens en de menselijke gemeenschap enerzijds en dieren anderzijds. Wat overigens zeker niet inhoudt, dat met dieren van alles gedaan mag worden. Het maken van mens-dier chimaeren waarbij menselijke hersencellen zich in de hersenen van een dier ontwikkelen, hoeft nog geen mensachtig wezen van het dier te maken, maar kan wel lijden bij het dier veroorzaken. Is het tot stand brengen van een mens-dier niet een benadering waarin de werkelijkheid – de natuur – naar onze hand gezet wordt? Waarbij natuurlijke grenzen of verordeningen overschreden worden, waar mogelijk nieuwe problemen door ontstaan? Is het niet beter in te zetten op andere vormen van orgaandonatie, dan in te zetten op het creëren van chimaeren?
Zet Genetica de deur open naar fascisme en eugenetica?
Het materialistisch naturalisme rukt op onder seculiere wetenschappers, getuige de woorden van Robert Museum Haynes, voorzitter van het 16e internationale congres van genetica. “Drieduizend jaar was een meerderheid van de mensheid ervan overtuigd dat de mens iets magisch was. Dat is een Joods-christelijke opvatting. De mogelijkheden van het manipuleren van de genen van de mens maakt veel meer duidelijk dat we in grote mate biologische machines zijn. Het traditionele denken, gebouwd op het idee dat de mens iets speciaals, unieks of zelfs iets heiligs zou zijn, is achterhaald” (17). In de tweede wereldoorlog was er het Arische ‘item’ van raszuiverheid.
Het werd pas echt gevaarlijk toen de Darwinistische filosofen probeerden een wetenschappelijke toepassing te formuleren als basis voor het eugenetische programma van de Nazi’s”. Ernst Haecel (18) verklaarde al veel eerder: “Honderdduizenden ongeneeslijke gekken, mensen met kanker, worden kunstmatig in leven gehouden, zonder de geringste winst voor zichzelf of het algemeen nut!”. Degene die niet paste in het Arische plaatje, werd als genetisch inferieur beschouwd. Als economische en sociale druk gecombineerd worden met verschillende vooroordelen, biedt het postmoderne constructivisme een aantrekkelijke basis om “ongewenste eigenschappen” uit het genenbestand te roeien.
Een uitdaging voor de christenen (4)
We gaan een nieuw tijdperk in de strijd voor de mensenrechten in. Het zich steeds meer ontwikkelende seculiere wereldbeeld, geworteld in een genetisch determinisme en postmodern constructivisme, laat weinig ruimte voor de waardigheid van het menselijk leven.
Als uiteindelijk de mens toch gekloond wordt, is het dan een persoon met constitutionele rechten? We zijn getuige van een depersonalisatie van menselijk leven, indien alle delen van mensen en genetische materialen worden verkocht en gepatenteerd, bewerkt en ontwikkeld. Ook krijgen we een ongekende verandering van traditionele sociale en juridische definities. Traditionele opvattingen van leven, geboorte, ziekte, dood, moeder, vader, en persoon beginnen te wankelen en zullen vervolgens verdwijnen (16). Met de depersonalisatie worden belangrijke morele verschillen door het wetenschappelijke en juridisch jargon verduisterd. Het gevolg is dat genetisch onderzoek en technologie steeds minder ethisch en menselijk verankerd is.
Ik denk dat het geloof in God en de mens als Zijn beelddrager de enige basis is waarmee men de tegenwoordige ontwikkelingen kan begrenzen. Christenen moeten een weloverwogen standpunt over genetische manipulatie en klonen innemen. Dit geldt voor zowel het gebruik van genetische technologie als ook de mogelijke gevaren. Volgens prof. dr. A. Houtepen, een rooms-katholieke theoloog, moet “genetica ook bezien worden vanuit het perspectief van de eindigheid van de mens en de kwetsbaarheid van het heelal. Bij rentmeesterschap past noch een antropocentrische exploitatiedrift, noch een kosmische gelijkstelling van mens met dier en plant (4). Het volstaan met technische oplossingen onder de voortzetting van de huidige levensstijl is niet gewenst”. Of zoals Frits Lange in een protestante visie op klonen van mens en dier stelt: “Van belang is niet alleen de vraag hoe God de wereld geschapen heeft maar vooral waartoe!” Gentechnologie moet net als ieder therapeutisch middel een middel zijn dat door God gezegend kan worden, en daarvoor is een uitgebreide toetsing bij iedere vorm en toepassing door de Heilige Geest en Gods Woord onmisbaar (4).
Literatuur
1. https://dnadialoog.nl
2. ND, 7 December 2019
3. http://nl.wikipedia.org/wiki/Genetische_technologie
4. Gerard Fellerin Promise Magazine, april 2015. https://stichting-promise.nl/christelijke-medische-ethiek/ethiek-rond-genetische-technologie.htm.
5. https://npvzorg.nl/thema/kiembaanmodificatie/
6. https://www.volkskrant.nl/wetenschap/het-gaat-hard-met-gentherapie-de-voortgang-aan-de-hand-van-vier-patienten~b18e4850/
7. Ministerie van Volksgezondheid Welzijn en sport. Essay DNA-dialoog, pdf
8. Leef nr. 6, december 2019 (Uitgave ‘Schreeuw om leven)
9. Leef nr. 5, oktober 2019 (Uitgave ‘Schreeuw om leven’)
10. https://stichting-promise.nl/christelijke-medische-ethiek/wanneer-begint-het-leven.htm
11. Lindeblad jaargang 16 nummer 2, december 2019
12. Ministerie van volksgezondheid, Pre-implantatie genetische diagnostiek om dragerschap te voorkomen.
13. https://www.rijksoverheid.nl/documenten/rapporten/2017/05/15/menselijke-organen-kweken-in-dieren-een-ethische-discussie
14 https://www.medischcontact.nl/nieuws/laatste-nieuws/nieuwsartikel/onderzoek-mens-diercombinaties-vraagt-ethische-toetsing.htm
15. https://npvzorg.nl/thema/embryo-onderzoek/
16. Jim Leffel, Genetische technologie, artikel ID: DE311. Jim Leffel doceert
Filosofie aan het Ohio Dominican Collegeen leidt het Crossroads Project
17. 17. Andrew Kimbell, The Human body shop. The engineering and marketing of Life (San Francisco Harper, 1993)
18. ErnstHaeckel, The wonders of Life, Harper 1905, geciteerd door Stern: Biological Science and the Roots of Nazism, American Scientist, 1988, p. 76
Kader (4)
Bezwaren gentechnologie
Geen gentechnologie op de kiembaan
Geen gentechnologie zonder bescherming van het embryo
Geen gentechnologie voor niet-geneeskundige doelen
Geen gentechnologie voor superras
Geen gen screening met statistisch dubieuze voorspellingswaarde
Geen gentechnologie alleen voor elite.
Geen gentechnologie die de biodiversiteit verminderd
Geen klonen van mensen
Geen gentechnologie die de generatiekloof verder vergroot
Geen gentechnologie die discriminatie van ras of gehandicapten bevordert.
Geen gentechnologie die het begrip ziekte oprekt.
Geen commerciële exploratie en oneerlijk gewin bij octrooien.
Geen overmatige rol gentechnologie in behandeling van de gehele mens naar geest-ziel en lichaam.
Gentechnologie moet net als ieder therapeutisch middel een middel zijn dat door God gezegend kan worden, en daarvoor is een uitgebreide toetsing door de Heilige Geest en Gods Woord onmisbaar.
Voordelen gentechnologie
Erfelijke afwijkingen eerder ontdekt en mogelijk voorkomen.
Erfelijke afwijkingen genezen door middel van gentherapie
Efficiëntere antibiotica, enzymproductie door fermentatie.
Resistentie en profylaxe tegen sommige ziekten.
Geneesmiddelen via recombinant DNA-technieken.
Niets uit dit artikel mag worden zonder uitdrukkelijke toestemming van de stichting en de auteur/vertaler worden overgenomen, gekopieerd of gebruikt worden. Uiteraard mag volgens de gangbare regels van bronvermelding er wel naar verwezen worden in andere publicaties. Neem bij twijfel eerst contact met ons op via het contactformulier.